Phương pháp truyền tin của tế bào mới được Nhà khoa học của Weill Cornell Medicine phát hiện, có thể tiết lộ phương thức mà tế bào ung thư “lợi dụng” hệ thống vận chuyển liên tế bào trong cơ thể, để phát tán tế bào ung thư đến vị trí mới trong cơ thể. Và các nhà khoa học cũng lợi dụng cách thức này để gắn thuốc đến đích tác dụng mong muốn.
Exosome là những cấu trúc nội sinh có thể di chuyển đi khắp các tế bào, mô và các cơ quan trong cơ thể như những “con thuyền” để trao đổi thông tin giữa các tế bào, vì vậy những “con thuyền” exosome đã được nghiên cứu nhằm mang thuốc đến đích tác dụng. Năm 2011, tiến sĩ Matthew Wood, Đại học Oxford, Anh cùng cộng sự công bố khả năng ứng dụng exosome để mang RNA can thiệp (small interfering RNA, siRNA) gây bất hoạt enzyme BACE1-một protein quan trọng trong quá trình phát sinh bệnh Alzheimer’s .Nghiên cứu này thực sự đã mở ra một quan niệm mới trong Y học nano, đó là dùng exosome để vận chuyển thuốc đến đích tác dụng.
Phương pháp để tạo ra các tiểu phân này đó là các mô tế bào ung thư được phân lập và tách thành những phần nhỏ, sau đó được nuôi cấy 24 giờ trong môi trường huyết thanh có bổ sung thêm penicillin/streptomycin. Môi trường được xử lý để phân lập exosome và phương pháp phân đoạn dòng trường thủy lưu bất đối xứng (Asymmetric Flow Field-Flow Fractionation – AF4) được sử dụng để tạo exomere từ exosome.
 |
Hình 1: Hình ảnh Exosomes (cấu trúc giống quả bóng trắng) và Exomeres (tím và vàng) được chụp
bởi kính hiển vi lực nguyên tử AFM (Atomic Force Microscope)
Vào năm 2016, một nhóm nghiên cứu ở Mỹ đã thành công trong việc bao gói các phân tử thuốc paclitaxel, hiện đang được sử dụng để điều trị ung thư vú, phổi và tuyến tụy vào trong các exosome, rồi giải phóng thuốc từ từ .Nhóm nghiên cứu đã chứng minh hiệu quả điều trị của phương pháp này trên khối u ở chuột. Thậm chí, hiệu quả điều trị đối với một dòng tế bào kháng thuốc còn đạt được với liều nhỏ hơn liều thông thường 50 lần. Đây là kết quả rất triển vọng, vì thực tế có rất nhiều thuốc diệt tế bào ung thư tác dụng tốt nhưng không thể tới được đích tác dụng hoặc gây ra nhiều tác dụng phụ do phải dùng liều lượng lớn.
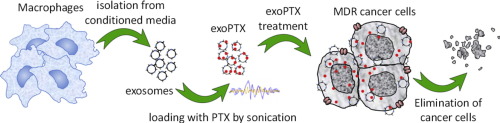
Hình 2: Mô tả quá trình phân lập exosome từ đại thực bào và quá trình gắn paclitaxel (PTX) vào các exosome
để mang thuốc tới tế bào ung thư MDR (Multiple Drug Resistance)
Trong một bài báo đăng trên tạp chí Nature Cell Biology, các nhà khoa học đã chỉ ra rằng một kỹ thuật tiên tiến được gọi là phân đoạn dòng trường thủy lưu bất đối xứng có thể sắp xếp các hạt nano, được gọi là exosome được tiết ra bởi các tế bào ung thư và chứa DNA, RNA, chất béo và protein. Kỹ thuật này cho phép các nhà nghiên cứu phân tách hai phân nhóm exosome khác nhau và để tạo ra một hạt nano mới, mà họ gọi là các exomere.
Exomere là hạt quan trọng nhất được tiết ra bởi các tế bào ung thư. Chúng nhỏ hơn , có cấu trúc và chức năng khác biệt với exosome. Exomere chủ yếu kết hợp với các tế bào trong tủy xương và gan, nơi chúng có thể làm thay đổi chức năng miễn dịch và sự trao đổi chất của thuốc. Exomere có đường kính nhỏ hơn 50 nanomét, so với các exosome nhỏ (Exo-S) có đường kính từ 60 đến 80 nanomet và các exosome lớn (Exo-L) có đường kính từ 90 đến 120 nanomet. Exosome và exomere cũng có các đặc tính sinh lý khác nhau, chẳng hạn như độ cứng và điện tích có thể ảnh hưởng đến vận chuyển của chúng trong cơ thể. Exosome và exomere cũng khác nhau trong cách ảnh hưởng đến ung thư. Exomere mang enzyme trao đổi chất vào gan, cơ quan này là trung tâm của việc chuyển hóa các thuốc thành các dạng không độc hại. Phát hiện này gợi ý rằng các tế bào ngoại lai tập trung vào gan để “tái lập trình” chức năng trao đổi chất của nó để thúc đẩy phát triển của khối u. Ngoài ra, exosome và exomere cũng có thể phát hiện được trong dịch sinh học của cơ thể như dịch bạch huyết có thể cho phép phát triển các chất chỉ điểm sinh học để phát hiện sớm ung thư hoặc các bệnh lý khác. Điều này sẽ giúp chúng ta hiểu rõ hơn về sinh bệnh học của ung thư, hướng dẫn các quyết định điều trị và phát triển các liệu pháp mới.
Kỹ thuật mới này có thể sẽ là một công cụ có giá trị cho các nhà khoa học và các nhà lâm sàng nghiên cứu khả năng vận chuyển sinh học của các hạt nano phức tạp và có thể hỗ trợ các xét nghiệm chẩn đoán bằng cách sử dụng chúng như những công cụ đánh giá sinh học.
Tổng hợp
Lê Hoàng Hảo
Tài liệu tham khảo:
1. https://www.sciencedaily.com/releases/2018/02/180221152358.htm
2. Kim MS et al, Development of exosome-encapsulated paclitaxel to overcome MDR in cancer cells. Nanomedicine, 2016. 12(3): p. 655-64
3. Zhang H et al, Identification of distinct nanoparticles and subsets of extracellular vesicles by asymmetric flow field-flow fractionation, Nature Cell Biology, 2018, https://doi.org/10.1038/s41556-018-0040-4.
- Thử nghiệm phi động vật – Kỷ nguyên mới cho nghiên cứu phát triển thuốc
- Qfitlia – phương pháp điều trị mới cho Hemophilia A hoặc B
- Mô hình “Netflix plus”: Giải pháp tài chính đột phá cải thiện tiếp cận thuốc tại các nước thu nhập thấp và trung bình
- Tỷ lệ Cholesterol “Xấu” (Non-HDL) trên Cholesterol “Tốt” (HDL) Cao Liên Quan Đến Nguy Cơ Tăng Huyết Áp và Bệnh Tim Mạch
- 6 loại thảo dược có khả năng gây tổn thương gan
- Tirzepatide giúp cải thiện tình trạng suy tim phân suất tống máu bảo tồn trên bệnh nhân béo phì
- FDA chấp thuận Ebglyss (Lebrikizumab) điều trị viêm da dị ứng
- Bệnh Alzheimer: Các loại thuốc mới được chấp thuận trên lâm sàng có tạo ra sự khác biệt thực sự không?
- FDA chấp thuận vắc-xin cúm dạng xịt mũi đầu tiên sử dụng tại nhà
- Tổn thương gan do thuốc
- Bốn hợp chất phenolic mới từ quả của loài Alpinia galanga
- Tác dụng kháng virus của gamma-mangostin
- Chế độ ăn Keto có thể đẩy nhanh quá trình lão hóa cơ quan
- Một số điểm mới trong quy định giá dịch vụ khám, chữa bệnh bảo hiểm y tế giữa các bệnh viện cùng hạng trên toàn quốc từ 17/11/2023
- Si rô ngô giàu fructose thúc đẩy sự phát triển khối u đường ruột ở chuột
- FDA cấp phép phê duyệt nhanh AMTAGVI điều trị ung thư hắc tố da
