Histon deacetylase (HDAC) là một nhóm các enzym xúc tác quá trình loại bỏ nhóm acetyl từ e-N-acetyl lysin amino acid của phần histon có trong nucleosom, có vai trò quan trọng trong điều hòa các protein histon. Sự acetyl hoá bị giảm dẫn đến giảm khoảng cách giữa nucleosom và ADN bao quanh. ADN quấn nucleosom chặt hơn làm đóng xoắn các nhiễm sắc thể, ngăn cản quá trình phiên mã. Các sai lệch trong quá trình phiên mã là một trong những nguyên nhân dẫn tới sự hình thành khối u. Vì vậy các HDAC là mục tiêu phân tử hấp dẫn cho nghiên cứu phát triển thuốc điều trị ung thư hiện nay
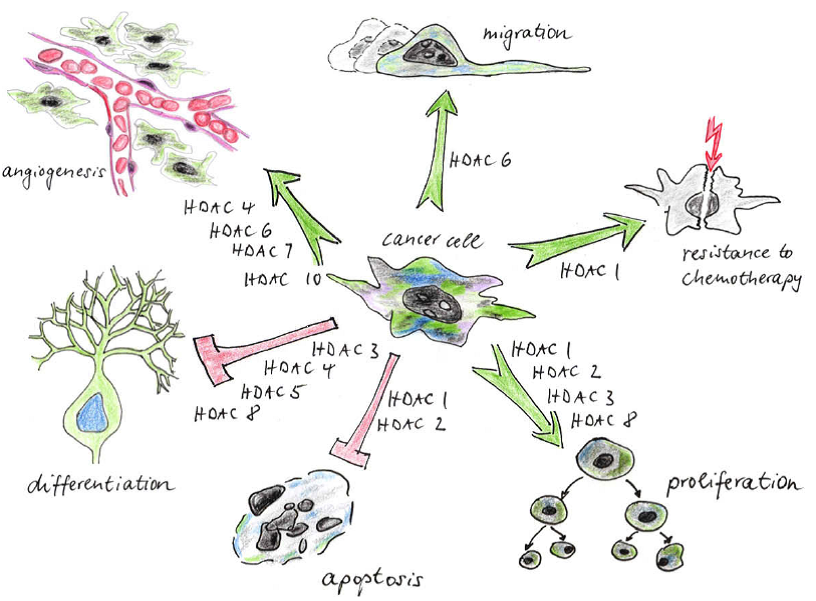
Hình 1. Vai trò, chức năng của các HDAC trong quá trình sinh học của tế bào ung thư.
1. Phân loại
Các chất ức chế HDAC (HDIs) được chia thành 5 nhóm chính dựa trên cấu trúc hóa học: các acid hydroxamic, các peptid vòng, các acid béo, benzamid và các dẫn chất ceton.
Tritisan – sản phẩm lên men của nấm Streptomyces dùng để điều trị nấm – là acid hydroxamic đầu tiên được tìm thấy có tác dụng ức chế HDAC, tuy nhiên nhóm này bị chuyển hoá nhanh và ức chế không chọn lọc lên các loại enzym HDAC. Các peptid vòng là nhóm có cấu trúc phức tạp nhất, tác dụng ức chế HDAC mạnh tương tự các acid hydroxamic gồm depsipeptid, apicidin, các peptid chứa nhóm hydroxamic. Các acid carboxylic và dẫn xuất benzamid cho tác dụng ức chế HDAC yếu.
Bảng 1. Phân loại các chất ức chế HDAC
|
Nhóm |
Hợp chất |
Pha lâm sàng |
Năm được FDA chấp thuận |
Loại ung thư |
|
Acid carboxylic |
Butyrat AN-9 (tiền thuốc) |
I, II |
Ung thư đại tràng |
|
|
AN-9 (tiền thuốc) |
I, II |
Tạng đặc, NSCLC |
||
|
Acid valproic |
III |
Ung thư vùng cổ, ung thư buồng trứng. |
||
|
Phenyl butyrat |
I |
Tạng đặc, AML/MDS |
||
|
Acid hydroxamic
|
Vorinostat (SAHA) |
2006 |
CTCL |
|
|
Belinostat (PXD101) |
2014 |
PTCL |
||
|
NVP-LAQ824 |
I |
Ung thư máu |
||
|
Pabinostat (LBH-589) |
III |
2015 |
U đa tủy, CTCL |
|
|
Givinostat (ITF-2357) |
II |
AML, ALL, MDS |
||
|
SB-939 |
II |
Ung thư tiền liệt tuyến |
||
|
CRA 024781 |
I |
Tạng đặc, ung thư máu |
||
|
JNJ-16241199 |
I |
Tạng đặc, ung thư máu |
||
|
Các benzamid |
Etinostat (SNDX-275, MS-275) |
II |
U lympho Hodgkin, ung thư phổi, ung thư vú |
|
|
CI-994 |
I, II |
Tạng đặc, NSCLC, tế bào thận, tuỵ |
||
|
Mocetinostat (MGCD-0103) |
II |
U lympho Hodgkin, u lympho nang, MDS |
||
|
Peptid vòng |
Depsipeptid (Romidepsin, FK228) |
2009 |
CTCL |
(Chú thích: NSCLC, ung thư tế bào phổi không nhỏ; AML, ung thư bạch cầu tủy bào cấp; MDS, hội chứng loạn sản tủy; CTCL, u lympho da tế bào T; ALL, ung thư bạch cầu cấp; CLL, ung thư bạch cầu mãn; PTCL, u lympho tế bào T ngoại biên)
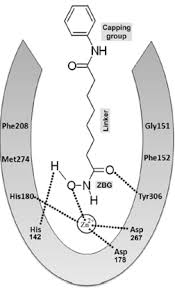 |
Hình 2. Công thức cấu tạo của một số chất ức chế enzym HDAC.
2. Cơ chế tác dụng
Các chất ức chế HDAC tác động lên tế bào ung thư theo ba cơ chế chủ yếu:
- Các chất ức chế HDAC gián tiếp gây ra sự chết tế bào theo chương trình: Các chất ức chế HDAC tác động lên những tế bào bình thường và tế bào ung thư với cùng mức độ gây ra G2 checkpoint (vị trí mà tại đó chu trình tế bào tạm thời dừng lại, chờ đến khi các điều kiện trở nên phù hợp thì chu trình lại tiếp tục). Những tế bào bình thường trải qua G2 checkpoint và tiếp tục phát triển, trong khi đó những tế bào ung thư tái tạo ADN tạo thành dạng 4n ADN và chuyển sang giai đoạn gây chết tế bào theo chương trình.
- Sự biệt hóa gây ra bởi các chất ức chế HDAC: Các chất ức chế HDAC tác động lên các tế bào ung thư gây ra sự ngừng tế bào ở pha G1, kết quả là gây ra sự biệt hóa tế bào ung thư.
- Ức chế chu trình tế bào: Các chất ức chế HDAC tác động lên các tế bào ung thư làm tăng tính sinh miễn dịch của tế bào ung thư và ức chế sự tạo mạch.
Ngoài tác dụng trực tiếp lên sự phát triển và sống sót của tế bào ung thư, các chất ức chế HDAC còn có những tác dụng gián tiếp đến sự phát triển khối u. Bằng cách làm tăng các phản ứng miễn dịch chủ thể và ức chế sự tạo mạch của khối u để có thể ngăn cản rõ rệt sự phát triển khối u ban đầu và sự di căn.
3. Liên quan cấu trúc – tác dụng của các chất ức chế HDAC
Các HDIs chia thành nhiều nhóm khác nhau nhưng có một số đặc điểm chung về mặt cấu trúc gồm 3 phần chính:
– Nhóm gắn với ion Zn2+ (Zinc binding group – ZBG) (A): tương tác với ion Zn2+ tại trung tâm hoạt động của các HDAC như acid hydroxamic, các thiol, nhóm o-aminoanilin của benzamid, mercaptoceton…, quyết định tính đặc hiệu và hiệu lực của HDIs.
– Vùng cầu nối sơ nước (B): thường là những hydrocacbon thân dầu có thể tạo các liên kết Van der Waals với kênh enzym.
– Nhóm khóa hoạt động (capping group) hay vùng nhận diện bề mặt (surface recognition group) (C): là các vòng thơm hoặc peptid vòng, thường nằm trên bề mặt enzym.
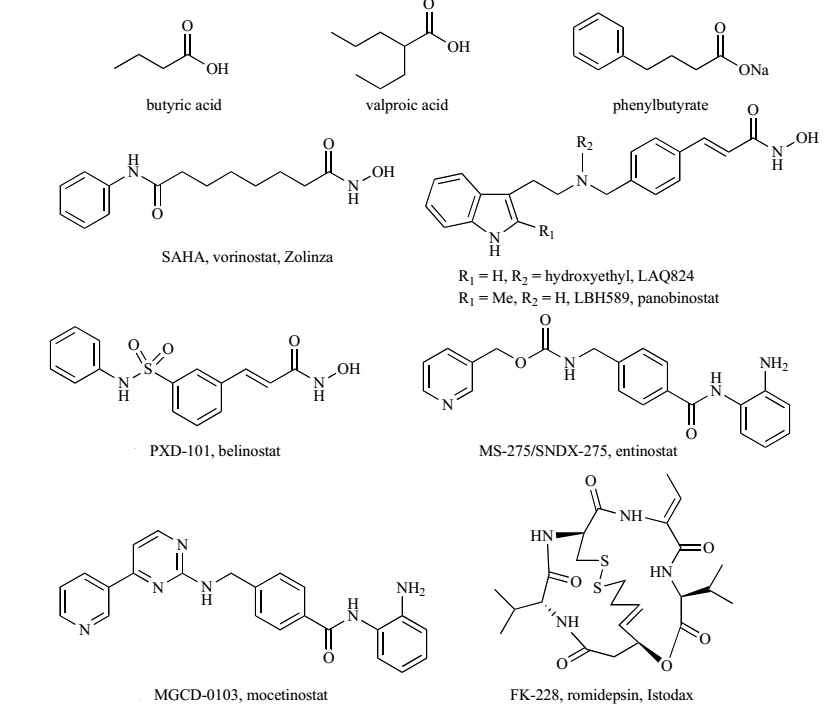
Hình 3. Cấu trúc của chất ức chế HDAC
Cấu trúc tinh thể kết tinh của các HDAC liên kết với một số chất ức chế HDAC cho thấy phần A, B và một phần của C nằm trong túi enzym, làm lấp đầy khoảng trống trong lòng kênh enzym. Phần còn lại của nhóm khóa hoạt động tương tác với phần vành trên bề mặt miệng túi enzym. Nhóm nhận diện bề mặt có thể liên kết cực và góp phần cải thiện dược động học cho các chất ức chế HDAC. Việc nghiên cứu thiết kế cấu trúc các chất mới đều dựa trên cấu trúc cổ điển này.
Tổng hợp
Cao Thị Cẩm Nhung
TLTK
- Chen P. C., et al., (2008), “Synthesis and structure-activity relationship of histone deacetylase (HDAC) inhibitors with triazole-linked cap group”, Med. Chem. Lett.
- Dokmanovic M. and Marks P.A., (2005), “Prospects: Histone deacetylase inhibitors”, Journal of Cellular Biochemistry.
- Johnstone R.W., (2002), “Histone Deacetylase Inhibitors: Novel Drugs for the Treatment of Cancer”, Nature Reviews Drug Discovery, 1(4).
- Qfitlia – phương pháp điều trị mới cho Hemophilia A hoặc B
- Mô hình “Netflix plus”: Giải pháp tài chính đột phá cải thiện tiếp cận thuốc tại các nước thu nhập thấp và trung bình
- Tỷ lệ Cholesterol “Xấu” (Non-HDL) trên Cholesterol “Tốt” (HDL) Cao Liên Quan Đến Nguy Cơ Tăng Huyết Áp và Bệnh Tim Mạch
- 6 loại thảo dược có khả năng gây tổn thương gan
- Tirzepatide giúp cải thiện tình trạng suy tim phân suất tống máu bảo tồn trên bệnh nhân béo phì
- FDA chấp thuận Ebglyss (Lebrikizumab) điều trị viêm da dị ứng
- Bệnh Alzheimer: Các loại thuốc mới được chấp thuận trên lâm sàng có tạo ra sự khác biệt thực sự không?
- FDA chấp thuận vắc-xin cúm dạng xịt mũi đầu tiên sử dụng tại nhà
- Tổn thương gan do thuốc
- Bốn hợp chất phenolic mới từ quả của loài Alpinia galanga
- Tác dụng kháng virus của gamma-mangostin
- Chế độ ăn Keto có thể đẩy nhanh quá trình lão hóa cơ quan
- Một số điểm mới trong quy định giá dịch vụ khám, chữa bệnh bảo hiểm y tế giữa các bệnh viện cùng hạng trên toàn quốc từ 17/11/2023
- Si rô ngô giàu fructose thúc đẩy sự phát triển khối u đường ruột ở chuột
- FDA cấp phép phê duyệt nhanh AMTAGVI điều trị ung thư hắc tố da
- WAINUA – THUỐC MỚI ĐIỀU TRỊ BỆNH ĐA THẦN KINH TÍCH TỤ AMYLOID DO ĐỘT BIẾN GEN
