Một nhóm các nhà nghiên cứu nước ngoài đã sử dụng các tiểu phân nano để vận chuyển một loại thuốc (vốn trước đây đã từng thất bại trong các thử nghiệm lâm sàng về tác dụng giảm đau) đến các vùng đặc hiệu của các tế bào thần kinh, từ đó, làm tăng đáng kể khả năng giảm đau ở các loài chuột. Những phát hiện này đã được công bố vào ngày 4 tháng 11 năm 2019 trên tạp chí Nature Nanotechnology.
Tiến sĩ Nigel Bunnett – Trưởng Khoa Khoa học Cơ bản và Sinh học vùng Đầu – Mặt tại Đại học Nha khoa thuộc Đại học New York (NYU) cho biết: “Chúng tôi đã lấy một loại thuốc chống nôn đã được FDA phê chuẩn và sử dụng một phương pháp vận chuyển thuốc mới, đã giúp làm tăng hiệu quả và thời gian tác dụng trên các mô hình động vật với bệnh đau gây ra do viêm và bệnh đau liên quan đến tế bào thần kinh”. “Việc phát hiện ra khả năng bao gói vào tiểu phân nano đã giúp tăng cường và kéo dài thời gian giảm đau trên các động vật thí nghiệm, từ đó, mang đến cơ hội phát triển các liệu pháp rất cần thiết, không sử dụng các thuốc nhóm opioid để giảm các cơn đau.”
Các opioid, một nhóm thuốc dùng để điều trị đau, có nguy cơ gây nghiện và dùng quá liều. Hơn nữa, hiệu quả của chúng giảm dần theo thời gian, đòi hỏi phải tăng liều để kiểm soát cơn đau. Tác dụng phụ của các opioid, bao gồm táo bón và ức chế hô hấp, sẽ nghiêm trọng hơn nếu tăng liều.
Tiến sĩ Bunnet cho biết: “Có nhiều lý do mà các opioid không phải là lý tưởng để điều trị đau. Với các vấn đề liên quan đến việc sử dụng các thuốc nhóm opioid đang diễn ra, đã cướp đi hàng trăm ngàn mạng sống, chúng ta cần những giải pháp thay thế an toàn hơn, hiệu quả hơn “.
Bunnett và các đồng nghiệp của ông nghiên cứu một họ protein gọi là thụ thể kết hợp protein G (G protein-coupled receptor), là mục tiêu của một phần ba các loại thuốc được sử dụng trên lâm sàng. Trong khi nhiều người nghĩ rằng các thụ thể hoạt động ở bề mặt của các tế bào thần kinh, nhóm nghiên cứu đã phát hiện ra rằng các thụ thể đã được hoạt hóa sẽ di chuyển vào trong tế bào để đến túi nội bào (endosome). Trong túi nội bào, các thụ thể tiếp tục hoạt động trong thời gian dài. “Hoạt động kéo dài của các thụ thể trong túi nội bào sẽ gây ra các cơn đau”.
Trong nghiên cứu trên tạp chí Nature Nanotechnology, các nhà nghiên cứu tại Đại học Nha khoa (thuộc NYU), Đại học Monash, Đại học Columbia và Đại học Santiago ở Chile đã tập trung nghiên cứu một thụ thể kết hợp protein G được gọi là thụ thể neurokinin 1.
“Các công ty dược phẩm lớn đã có các kế hoạch phát triển các chất đối kháng thụ thể neurokinin trong điều trị các bệnh mãn tính, bao gồm đau và trầm cảm. Tuy nhiên, trong các thử nghiệm ở người, mọi thứ đều thất bại”, Bunnett nói. Thụ thể neurokinin là được xem là ví dụ tiêu biểu cho những thất bại trong việc khám phá và tìm kiếm các thuốc để điều trị và giúp giảm đau.
Các nhà nghiên cứu nghi ngờ rằng những loại thuốc này không hiệu quả vì chúng được thiết kế để phong tỏa các thụ thể ở bề mặt tế bào chứ không phải trong các túi nội bào.
Để đưa thuốc đến các túi nội bào, các nhà nghiên cứu đã chuyển sang dạng tiểu phân nano – dạng bao gói siêu nhỏ dùng để vận chuyển thuốc. Bunnett và các đồng nghiệp của ông đã bao gói vào trong các tiểu phân nano thuốc ức chế thụ thể neurokinin là aprepitant, một loại thuốc được FDA phê chuẩn dùng để ngăn ngừa buồn nôn và nôn. Những thuốc này đã thất bại trong các thử nghiệm lâm sàng như một loại thuốc giảm đau.
Các tiểu phân nano được thiết kế để đi vào các tế bào thần kinh dẫn truyền tín hiệu đau và giải phóng chất vận chuyển là aprepitant vào trong các túi nội bào có chứa thụ thể neurokinin. Aprepitant dạng nano giúp làm giảm cơn đau ở chuột hiệu quả hơn và kéo dài hơn so với các liệu pháp truyền thống, bao gồm cả nhóm opioid. Hơn nữa, việc cung cấp dạng thuốc nano giảm thiểu liều lượng thuốc cần thiết để điều trị cơn đau và hữu ích trong việc giảm tác dụng phụ.
Bunnett phát biểu rằng: “Quá trình nghiên cứu về cơ bản là đưa thuốc vào trong các túi nội bào”. “Bằng cách vận chuyển một loại thuốc giảm đau mà trước đây không có hiệu quả vào trong các túi nội bào, nó trở nên rất hiệu quả trong điều trị đau.”
Về phương diện bào chế, các tiểu phân nano này được thiết kế bằng cách sử dụng các chất mang là các polyme có khả năng nhạy cảm với pH, từ đó, sau khi vận chuyển thuốc vào bên trong tế bào, các tiểu phân nano có thể giải phóng thuốc tại vị trí các túi nội bào với pH acid hơn.
Cơ chế tự sắp xếp để hình thành các tiểu phân nano này phụ thuộc vào nồng độ và cơ chế giải phóng của chúng lại phụ thuộc vào pH. Chẳng hạn, việc tăng nồng độ polyme 2-[N,N-(diisopropylamino)ethyl] methacrylate (DIPMA) dẫn đến quá trình tự sắp xếp của các tiểu phân nano trong dung dịch nước.
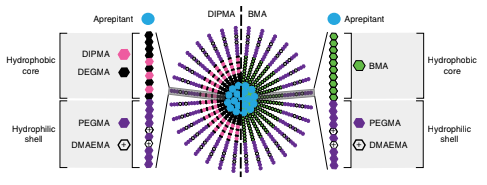
Hình 1: Cấu trúc của các tiểu phân nano phụ thuộc pH (DIPMA) và không phụ thuộc pH (BMA –(Butyl methacrylate)). Các tiểu phân nano có chung lớp vỏ ưa nước của (PEGMA (poly(ethylene glycol) monomethyl ether methacrylate )-co-DMAEMA (2-[N,N-(dimethylamino)ethyl] methacrylate) nhưng có lõi kỵ nước khác nhau: P (DIPMA-co-DEGMA (di(ethylene glycol) methyl ether methacrylate)) hoặc BMA.
Các tiểu phân nano polyme này chứa một amin bậc ba ở mỗi đơn vị DIPMA với định hướng xoay vào bên trong lõi. Ở pH
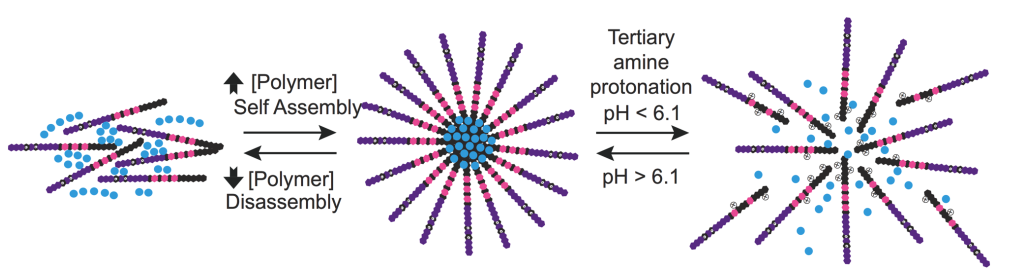
Hình 2: Sơ đồ quá trình tự sắp xếp tiểu phân nano và cơ chế giải phóng phụ thuộc pH
Các nhà nghiên cứu đang tiếp tục nghiên cứu việc sử dụng các tiểu phân nano trong việc vận chuyển thuốc giảm đau không chứa opioid, bao gồm cả cách đưa chúng hướng đích chỉ đến các tế bào thần kinh cảm nhận cảm giác đau, từ đó, cho phép dùng thuốc với liều thấp hơn nữa. Các nhà nghiên cứu nhấn mạnh rằng các nghiên cứu sâu hơn là cần thiết trước khi thuốc giảm đau dạng nano có thể được thử nghiệm ở người.
Tổng hợp
Lê Hoàng Hảo
Tài liệu tham khảo:
- https://www.sciencedaily.com/releases/2019/11/191104112916.htm
- Paulina D. Ramírez-García et al (2019), “A pH-responsive nanoparticle targets the neurokinin 1 receptor in endosomes to prevent chronic pain”, Nature Nanotechnology, 14 (12), 1150-1159.
- Qfitlia – phương pháp điều trị mới cho Hemophilia A hoặc B
- Mô hình “Netflix plus”: Giải pháp tài chính đột phá cải thiện tiếp cận thuốc tại các nước thu nhập thấp và trung bình
- Tỷ lệ Cholesterol “Xấu” (Non-HDL) trên Cholesterol “Tốt” (HDL) Cao Liên Quan Đến Nguy Cơ Tăng Huyết Áp và Bệnh Tim Mạch
- 6 loại thảo dược có khả năng gây tổn thương gan
- Tirzepatide giúp cải thiện tình trạng suy tim phân suất tống máu bảo tồn trên bệnh nhân béo phì
- FDA chấp thuận Ebglyss (Lebrikizumab) điều trị viêm da dị ứng
- Bệnh Alzheimer: Các loại thuốc mới được chấp thuận trên lâm sàng có tạo ra sự khác biệt thực sự không?
- FDA chấp thuận vắc-xin cúm dạng xịt mũi đầu tiên sử dụng tại nhà
- Tổn thương gan do thuốc
- Bốn hợp chất phenolic mới từ quả của loài Alpinia galanga
- Tác dụng kháng virus của gamma-mangostin
- Chế độ ăn Keto có thể đẩy nhanh quá trình lão hóa cơ quan
- Một số điểm mới trong quy định giá dịch vụ khám, chữa bệnh bảo hiểm y tế giữa các bệnh viện cùng hạng trên toàn quốc từ 17/11/2023
- Si rô ngô giàu fructose thúc đẩy sự phát triển khối u đường ruột ở chuột
- FDA cấp phép phê duyệt nhanh AMTAGVI điều trị ung thư hắc tố da
- WAINUA – THUỐC MỚI ĐIỀU TRỊ BỆNH ĐA THẦN KINH TÍCH TỤ AMYLOID DO ĐỘT BIẾN GEN
